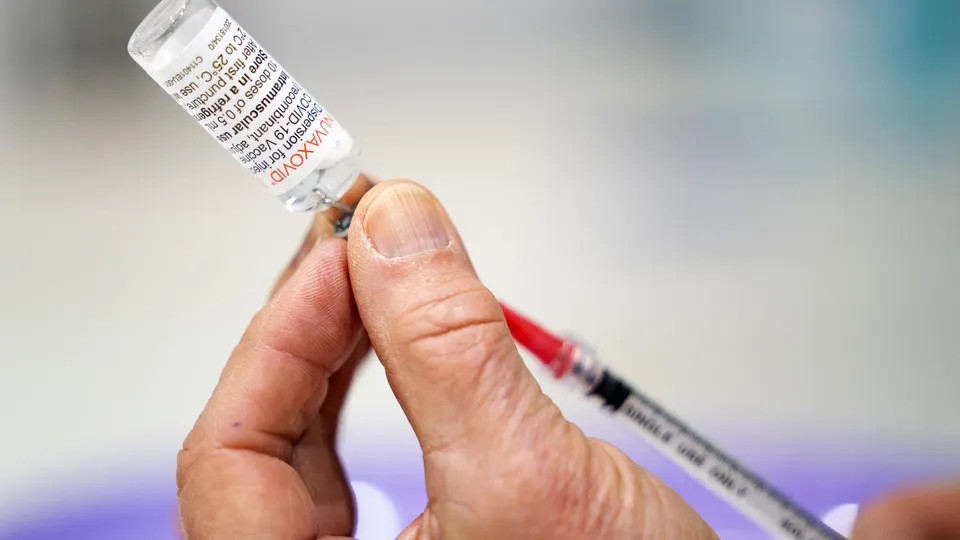
FDA phê duyệt sử dụng khẩn cấp vaccine COVID-19 Novavax
FDA phê duyệt sử dụng vaccine COVID-19 từ Novavax cho người trưởng thành từ 18 tuổi trở lên, trong bối cảnh biến thể phụ BA.5 đang lây lan nhanh.
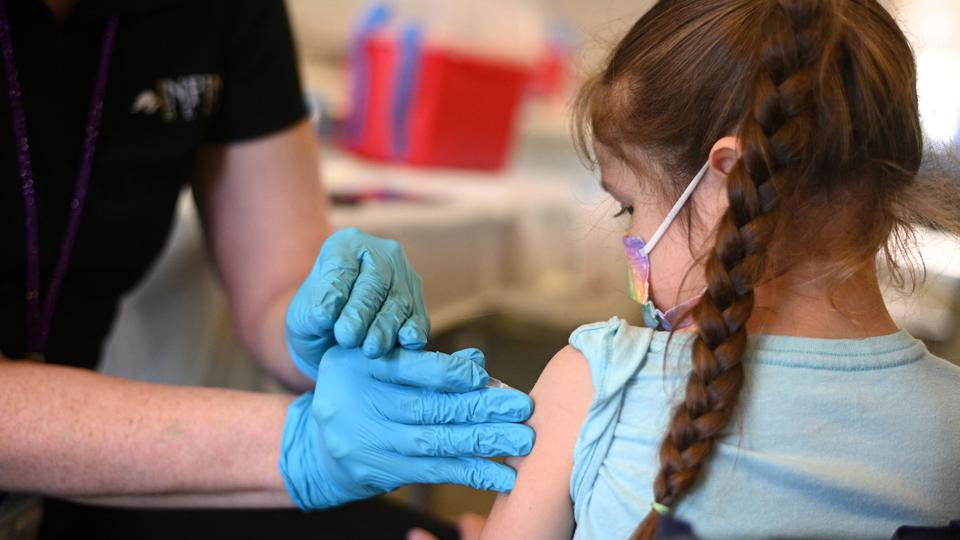
Vào ngày 13.7, Cục quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đã cấp phép sử dụng khẩn cấp vaccine COVID-19 của Novavax làm mũi tiêm thứ tư cho người dân Mỹ từ 18 tuổi trở lên, khi nước này đang tăng cường tiêm chủng trong bối cảnh biến thể phụ của omicron, BA.5 lây lan nhanh.
Vaccine của Novavax có cơ chế hai mũi tiêm cách nhau 3 tuần tận dụng công nghệ cũ từ hai loại vaccine phòng viêm gan B và Zona, với protein gai COVID-19 giúp hệ miễn dịch nhận biết và phòng ngừa lây nhiễm trong tương lai.
Kết quả từ thử nghiệm lâm sàng của Novavax cho thấy vaccine đạt hiệu quả 90,4% trong việc ngăn ngừa mắc COVID-19 ở mức độ nhẹ, trung bình hoặc nặng, khi không ghi nhận trường hợp mắc bệnh trung bình hoặc nặng nào trong 17.200 người được tiêm ngừa.
Giới chức y tế hi vọng vaccine dựa trên protein của Novavax sẽ thu hút người Mỹ còn e ngại hoặc không thể tiêm vaccine sản xuất bằng công nghệ mRNA mới từ Pfizer-BioNTech và Moderna. Theo trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ (CDC), khoảng 1 trên 5 người dân Mỹ vẫn chưa tiêm mũi vaccine nào.
Vaccine Novavax đã được cấp phép sử dụng và phân phối tại hàng chục quốc gia và Liên minh châu Âu (EU). Vào ngày 11.7, chính quyền tổng thống Joe Biden thông báo đã đặt mua 3,2 triệu liều vaccine Novavax, từng gặp khó khăn về quá trình sản xuất trong hai năm phát triển, để cung cấp trên toàn nước Mỹ theo phê duyệt từ FDA. Vào tuần trước, CDC thông báo biến chủng omicron mới BA.5 là biến thể lây nhiễm chủ đạo tại Mỹ, khiến số ca mắc và nhập viện gia tăng.
Xem thêm: Vaccine kết hợp cúm và COVID-19 của Novavax có “kết quả thử nghiệm khả quan”
Biên dịch: Minh Tuấn
Theo forbes.baovanhoa.vn (https://forbes.baovanhoa.vn/fda-phe-duyet-su-dung-khan-cap-vaccine-covid-19-novavax)